気体が従う法則には主にボイルの法則、シャルルの法則、アボガドロの法則が挙げられます。
当ページではこれらすべてを総括した関係である、状態方程式を紹介します。
特に重要になるのは理想気体の状態方程式で、現実に観測される事象では理想からどのくらいかけ離れているかを見る1つの指針になります。
■目次■
状態方程式とは
状態方程式とは、気体がある体積 \(V\)、ある温度 \(T\)、ある物質量 \(n\) を持つときに成り立つ方程式であり次のように表現されます。
\[ P = P(T; ~ V, ~ n) \]
ここで \(P\) は気体の圧力です。
\(P(T; ~ V, ~ n)\) は一価関数 ( 解が1つの関数 ) であり、すなわち気体の温度、体積、物質量を定めれば、気体の圧力は一意に定まるということです。
特に理想的に振る舞う理想気体においては、理想気体の状態方程式として以下の関係が知られています。
\[ PV = nRT \]
ここで \(R\) は定数であり気体定数という名称が与えられています。
気体定数は \(R = 8.31451 ~ [\text{Pa⋅m}^3\text{/mol⋅K}]\) の値を持ちます。
理想気体とは、その名の通り「理想」と付いているだけあって、現実には存在しません。
とは言え、次に示す条件を満たせば実在する気体でも理想気体の状態方程式(2)を適用することができます。
- 低圧条件下 または
- 高温条件下
式(2)と照らし合わせながら考えてみてもらいたいのですが、要するに気体の体積が大きい状況と思ってもらえれば良いです。
「なぜ上記の条件だと実在する気体でも理想的に振る舞うのか」という更に掘り下げた内容については「熱力学」の範囲を超えるので割愛します。
気体の3つの性質
冒頭でも触れたとおり、気体の性質とは主に次の3つの法則が挙げられます。
- ボイルの法則
- シャルルの法則
- アボガドロの法則
詳しくは上記遷移先のページを参照してもらい、以下では簡単な概要のみ紹介することにします。
ボイルの法則 : 気体の圧力と体積の関係
ボイルの法則は気体の圧力 \(P\) と体積 \(V\) の関係を表したもので、次式で表現されます。
\[ PV = \text{Const.} \]
グラフで示すと以下のとおり。

非常に簡単な関係ですが、注意点として気体の温度と物質量は一定であることが要求されます。
ボイルの法則は経験的にも理解がしやすい現象です。例えば次に示す様な気体を封入した容器を考えましょう。

容器の蓋を押さえて体積を小さくしていくと、気体の圧力が強まり蓋を逆向きに押し返そうとします。
圧縮初期ではそれほどでもありませんが、圧縮を続けて体積が小さくなると更に圧力は強くなっていきます。
このように気体の圧力 \(P\) と体積 \(V\) はボイルの法則に従って反比例する関係となっているのです。
シャルルの法則 : 気体の温度と体積の関係
シャルルの法則は気体の温度 \(T\) と体積 \(V\) の関係を表したもので、次式で表現されます。
\[ \frac{V}{T} = \text{Const.} \]
グラフで示すと以下のとおりです。

このとおり気体の体積 \(V\) と温度 \(T\) の間には比例関係が成り立ちます。
だたし、気体の圧力と物質量は一定であることが要求されます。
シャルルの法則は空気を入れた風船をイメージすると分かりやすいです。
風船は温度が高くなると膨張しますが、温度が低くなると縮んてしまいます。

このことからもシャルルの法則によって、気体の体積が温度に比例するというのは納得が行くでしょう。
ここで温度 \(T\) の次元に注意する必要があり、一般的に知られるセルシウス温度 \([\text{℃}]\) ではなく絶対温度 \([\text{K}]\) が利用されます。
絶対温度 \(T\) とセルシウス温度 \(t\) は次の関係が成立しており、相互に変換が可能です。
\[ T = t + 273.15 \]
セルシウス温度は負の値を取りますが、絶対温度は正の値を取るように定められています。
もしシャルルの法則 ( 式(4) ) にセルシウス温度 \(t\) を適用してしまうと、気体の体積が負になる温度範囲が存在してしまうことになります。
この問題を絶対温度の利用によって防ぐことができます。
アボガドロの法則 : 気体の体積と物質量の関係
アボガドロの法則は気体の体積 \(V\) と物質量 \(n\) の関係を表したもので、次式で表現されます。
\[ \frac{V}{n} = \text{Const.} \]
アボガドロの法則は気体の圧力と温度が一定条件の下で成立する法則です。
同温・同圧条件では、気体の体積は物質量に比例します。
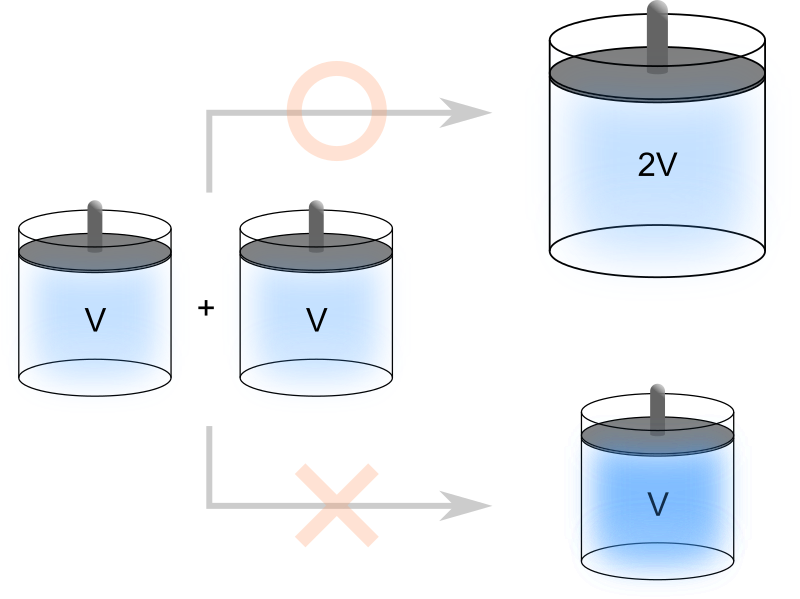
例えば体積が \(V\) の気体が封入された容器を2つ用意し、それらを混合した後に気体が占める体積を測定すると \(2V\) となります。
当然のように思われるかもしれませんが、繰り返し言うようにこれは同温・同圧条件だからこそ成立する関係です。
3つの気体の性質を繋ぐ定数 : 気体定数
理想気体の状態方程式は、ボイルの法則、シャルルの法則、アボガドロの法則が組み合わさって成り立っています。
それぞれの法則は以下の通り。
- ボイルの法則 : \(PV = \text{Const.}\)
- シャルルの法則 : \(\frac{V}{T} = \text{Const.}\)
- アボガドロの法則 : \(\frac{V}{n} = \text{Const.}\)
これらの関係は既に述べた気体定数 \(R\) によって橋渡しされます。
その流れを以下で確認していきます。
まず上記の3つの法則に共通して含まれるのは気体の体積 \(V\) であり、対応する物理量 \(P\)、\(T\)、\(n\) がどういう関係にあるかに注意すると
\[ V \propto \frac{nT}{P} \]
すなわち、体積 \(V\) は、圧力 \(P\) に反比例し、温度 \(T\) および物質量 \(n\) に比例するということです。
式(6)で登場する「 \(\propto\) 」は左辺と右辺に比例関係があることを表す記号です。
このように記述できさえすれば、あとは単に比例定数を設けて等号で結べば良く、その比例定数が気体定数 \(R\) となります。
\[ \begin{align*} V &= R \frac{nT}{P} \\[15pt] \therefore ~ PV &= nRT \end{align*} \]
ちなみに気体定数は前述のとおり、\(8.31451 ~ [\text{Pa・m}^3\text{/mol・K}]\) の値が与えられていますが、
これは \(1 ~ [\text{mol}]\) の気体が標準状態 \(25 ~ [\text{℃}]\), \(1.013 \times 10^5 ~ [\text{Pa}]\) にあるとき、体積が \(24.8 ~ [\text{L}]\) であることを利用して式(7)から計算することで得られます。
また理想気体の状態方程式の驚くべき点は、気体の種類に依存せず常に成立することです。
もし気体の種類に依存していれば、気体定数は各々の気体で異なる値を取る必要があります。
しかしその必要はなく、気体が理想的に振る舞う条件が満たしさえすれば理想気体の状態方程式を適用することが可能なのです。
このような普遍性は物理化学の最大の魅力ですね☆。
まとめ
気体の状態が定まれば、すなわち気体の温度 \(T\)、体積 \(V\)、物質量 \(n\) が定まれば気体の圧力 \(P\) が一意に決まります。
この関係を表す方程式を状態方程式といって、\(P(T; ~ V, ~ n)\) の様に表現します。
特に理想的な振る舞いをする理想気体において成立する状態方程式は非常に重要で、その方程式は次式のとおりです。
\[ PV = nRT \]
ここで \(R\) は気体定数と呼ばれる定数であり、\(8.31451 ~ [\text{Pa・m}^3\text{/mol・K}]\) の値が与えられています。
この方程式の驚くべきところは、その普遍性にあります。
理想気体の状態方程式は、気体の種類に依存せず理想的に振る舞う圧力・温度範囲であれば様々な気体に対して適用が可能です。
【サイト運営 : だいご】
今年で物理化学歴12年目になります。
大学入試2次数学でたった3割しか得点できなかったいわゆる数弱落ちこぼれ。それでも好きこそものの上手なれと言ったところか、学会で最優秀賞受賞したり首席卒業できてしまったので、役に立つ知識を当サイトに全て惜しみなく公開しようと思います。ブックマークをオススメ。

