体積と物質量の関係 : アボガドロの法則
3つ目の法則は体積と物質の量との関係です。
ここでいう物質とは容器に封入された気体のことを指します。
本題である体積と物質の量の関係にふれる前に、そもそも物質の量をどのように記述していくかについて言及しておく必要があります。
物質の量
物質がどのくらい存在するかを表す物理量として物質量を導入します。
物質量は、馴染み深い「個」や「\(\text{g}\)」、「\(\text{L}\)」といった次元ではなく「\(\text{mol}\)」が利用されます。
「\(\text{mol}\)」というのは、私達が目視できない原子の存在を認めた上で定義される次元であり
1 \([\text{mol}]\) は「炭素12 \([\text{g}]\) に含まれる炭素原子の個数」と決められています。
卵 10 個入りで 1 パックといった具合に、原子の個数を直接数えるのではなく、原子の集まりを 1 として扱っていくのです。
ただどうしてその様な量を定義したのかは、炭素12 \([\text{g}]\) に含まれる炭素原子の個数を見れば分かります。
式(18)\[ N_A = 6.022 \times 10^{23} ~ [\text{/mol}] \]
\(N_A\) は原子数を表すために与えられた記号でありアボガドロ数と呼ばれます。
そしてその数なんと 6000垓 に上ることが実験的に分かっています。
とんでもない膨大な数です。しかも中途半端な。
そこでこの数量を愚直に利用するよりも 6000垓個 のことをすなわち 1 \([\text{mol}]\) と決めた方が圧倒的に便利なワケです。
ちなみにアボガドロ数の次元 \([\text{/mol}]\) は、物質 1 \([\text{mol}]\) あたりに何個の原子や分子があるかを意味します。
\([\)個\(\text{/mol}]\) とでも表記したほうが分かりやすいかもしれませんが、「個」は次元として扱わないので斜線の前は何も表記しないことも知っておきましょう。
アボガドロの法則
さて、気体の体積と物質の量との関係を見ていきましょう。
結論から述べると、物質量を \(n\) として次の比例関係が成り立つことが知られています。
式(19)\[ V = C_3 n ~~~ (~ C_3 > 0 ~) \]
これはアボガドロの法則に基づいていて、その法則の具体的内容とは
同じ圧力、同じ温度下におかれた同じ体積の気体に含まれる分子の数は同じであるということです。
ここに同じ圧力、同じ温度下 ( たとえば標準状態 \(25 ~ [\text{℃}]\)、\(1.01325 \times 10^5 ~ [\text{Pa}]\) ) で同じ体積の容器を2つ用意したとします。
続いて、これら2つの気体を混合してみましょう。重量を測定すると2倍になります。
そして、体積も2倍になります。
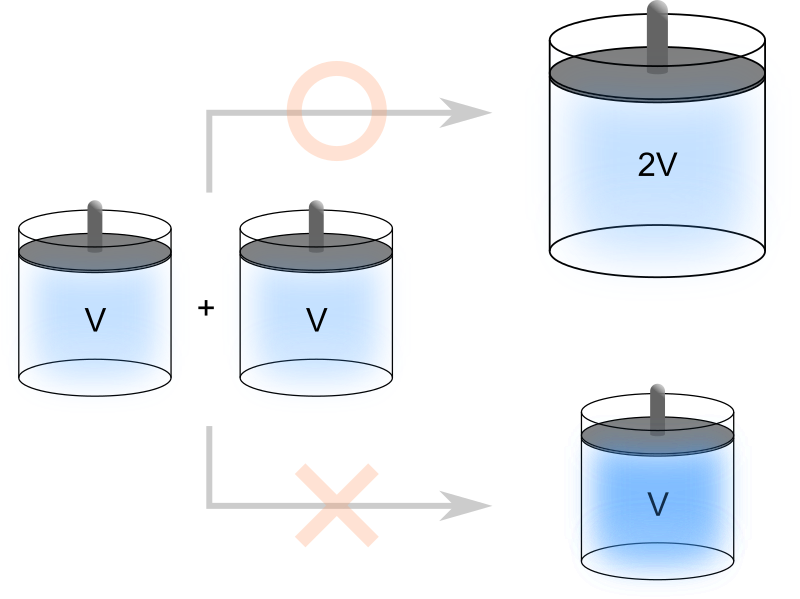
もし混合しても混合前と同じ体積を維持した場合、容器内に気体分子が混み合ってしまいます。
その結果圧力は上がるので大気圧と釣り合わなくなります。
容器内の圧力と大気圧が釣り合ったところまで容器の蓋が移動し、結果として元の2倍の体積を持つようになります。
混合前と同じ体積を維持させるには
