熱力学のメインとなる内容は、等温操作や断熱操作を通して得られる応答から系内部の状態を把握することです。
しかし熱力学系を実用的に利用することを考えることも可能です。
当ページでは熱力学系に効率よく仕事をさせることができるカルノーサイクルについて図を用いながら詳しく解説していきます。
カルノーサイクルによって理想気体がする仕事やその効率を計算できるようになる事が目標です。
■目次■
まず初めにそもそも仕事がどの様にして生み出されるものなのかを簡単に説明します。
そして熱力学系が外界に正味で正の仕事をするためには、2つの熱源が必要になることを見ていきます。
ここは実は本質的な内容であるため、順を追ってしっかり理解をしていくことに努めましょう。
温度差の必要性
早速結論から言うと、熱力学系が外界へ仕事をするときに必要になるのは「温度差」です。
ここでポイントとなるのは「差」という要素。
仕事と「差」の関係性を理解してもらうために、以下にいくつか例を示しましょう。
例えば回転する水車を思い浮かべて下さい。

高い所から流れてきた水は水車の受けに溜まり、水車が回ることによって水は低い所に移動します。つまり動力源は水の「高低差」だと理解できます。
他にも電池による電気的仕事はより身近な例です。電子機器を機能させるためには回路に電流を流す必要があります。電池によって回路に「電位差」が作り出されることによって電流が流れるのです。
このように注目している対象が外へ仕事をするとき、そこには何らかの「差」が存在すると考えられます。それが熱力学系の場合は「温度差」だったということです。
2つの熱源を用いて熱力学系から仕事を取りだす
高温熱源と低温熱源の利用
前節では熱力学系に仕事をさせるには「温度差」が必要であることを述べました。
回転する水車の類推として考えると、温度の高い所から流れてきた熱が熱力学系に仕事をさせ、その後熱は温度の低いところに排出されるといった状況を思い浮かべることができます。
この考えによると以下の図に示したような2つの熱源、すなわち高温熱源と低温熱源が必要となってくることが予想されます。
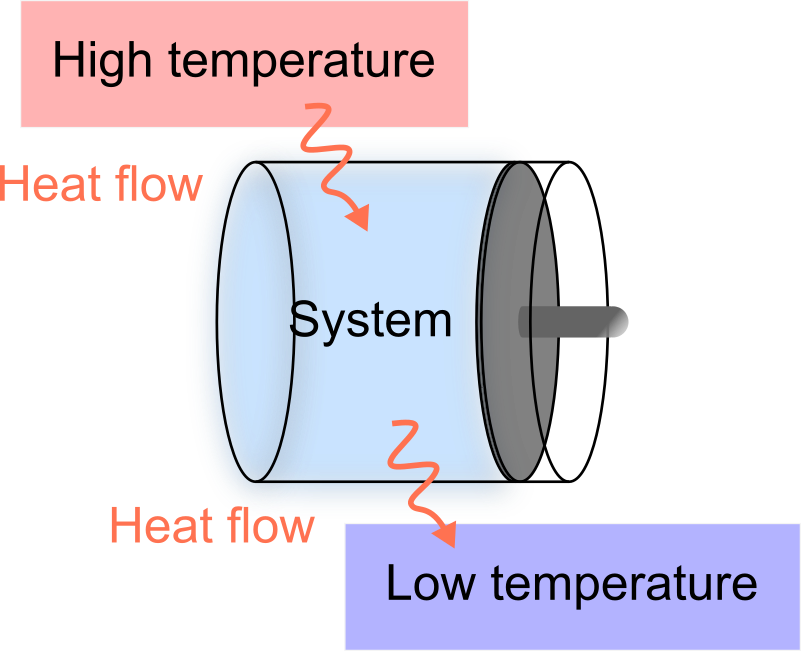
2つの熱源の必要性
しかし熱力学系に仕事をさせるのに本当に熱源が2つも必要なのでしょうか。
等温操作で説明したことを思い出せば、下図のように等温仕事によって系は外部環境から熱を吸収しながら系を膨張させることができるのでした ( またその逆も可能 )。
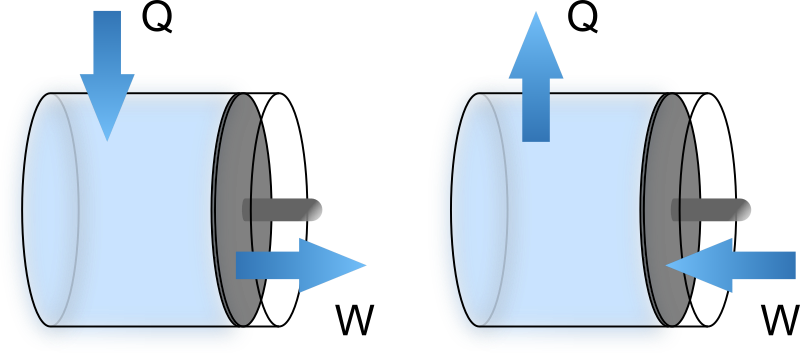
上記の場合、熱源とは熱力学系 ( シリンダー ) を取り囲む等温環境を指しています。つまり熱源は1つと言えます。
この場合にとっても熱力学系に仕事をしてもらうのに、わざわざ2つも熱源は要らないのではないかと思われるかもしれません。
しかし後に示すとおり熱源が1つでは系から正味の仕事を取りだすことができないのです。
そもそも上記のように熱力学系が膨張して外へ仕事をしてくれたとしても、それは単発で終了してしまいます。
実用面で考えれば電池のように電力を使い切っても充電すれば繰り返し仕事を得られる様な性能を持たせるべきでしょう。
具体的には熱力学系が膨張仕事をした後に圧縮させて元の状態に戻すことで連続的に仕事が得られるようにする方法が挙げられます。
そしてこのような膨張と圧縮を含む過程から外界にする正味の仕事が正となるようにするためには、2つの異なる温度の熱源を利用する必要があるのです。
カルノーサイクル
サイクルと4つの過程
熱力学系から正の仕事を取りだすためには操作の途中で異なる温度の熱源を用いる必要があります。
基本的に熱は温度の高い所から低い所に流れるため、それに反さないように考えれば、熱力学系の操作においても高温熱源から熱を吸収する等温操作と、低温熱源へ熱を逃がす等温操作を考えれば良いでしょう。
前節でもイラストを用いて示しましたが、熱力学系に外部環境から熱を吸収させるには外界へ仕事をさせる必要があります。
一方、熱力学系から熱を逃がすには外から仕事を行う必要があります。
しかしこれら異なる熱源を用いた2つの操作によって繰り返し膨張と圧縮をしようと考えると、次に示すような問題が生じてしまいます。
下図に示すのは理想気体における等温線の曲線群ですが、見ての通り異なる2つの等温線は互いに交わることはありません。
熱力学系を操作するとき内部の状態はこの曲線上を移動するように変化していくので、要するに上記2つの等温操作を連続して行うことはできないのです。

そこで異なる等温操作を結ぶために断熱操作を導入します。
一般に断熱操作では系の体積を操作することによって、その前後で内部の温度も変化することを思い出して下さい。
つまり次の図で示すように等温線 ( 赤 ) と断熱線 ( 青 ) は互いにメッシュ状に交わり、断熱操作によって異なる等温線の間を行き来することができるようになります。

この内、高温熱源 \(T_{\text{high}}\)、低温熱源 \(T_{\text{low}}\) に相当する2つの等温線と、任意の断熱線2つを取り出したものが以下の図です。

こうして図中の点Aを起点にB、C、D、Aと元に戻って来れるような、すなわち繰り返し膨張と圧縮が行える操作を考え出せたことになります。
記号で表せば次の式(1)のとおり。
\[ (T_{\text{high}}; ~ V_{\text{A}}, ~ n) \rightarrow (T_{\text{high}}; ~ V_{\text{B}}, ~ n) \rightarrow (T_{\text{low}}; ~ V_{\text{C}}, ~ n) \\[15pt] \rightarrow (T_{\text{low}}; ~ V_{\text{D}}, ~ n) \rightarrow (T_{\text{high}}; ~ V_{\text{A}}, ~ n) \]
このように1周回って元の状態に戻るような過程をサイクルと呼びます。
またこの等温操作と断熱操作の4つの過程からなるサイクルを考案者にちなんでカルノーサイクルと呼びます。
※状態図上に示された等温線と断熱線はそれぞれ熱力学系がサイクルによって通る経路です。状態図上に実線で曲線を引くことができるのは平衡状態が崩れていないときのみです。つまり、カルノーサイクルを構成する4つの操作はそれぞれ準静的操作であることに注意して下さい。
\(P\)-\(V\) 図と系がする仕事の関係
カルノーサイクルがそれぞれ2つの等温準静的操作および断熱準静的操作からなることを見てきました。
では実際に熱力学系がカルノーサイクルを1周するときに得られる仕事量について考えてみましょう。
まず準静的過程において熱力学系が外界へする仕事がどのように表現されるのか軽くおさらいしておくと…
気体の圧力と体積変化の積によって仕事を表現できますが、体積変化に伴って気体の圧力も変化する場合は微小仕事 \(P dV\) の積分として表現します。
\[ W_{\text{max}} = \int_{V_0}^{V} P dV \]
式(2)は熱力学系の体積を \(V_0\) から \(V\) に変化させたときの仕事の表式です。
また式中の下付き文字 max は最大仕事であることを意味しており、準静的操作によって系が外界にすることができる最大の仕事を表します。
更に式(2)は数学的にみるとより理解しやすく、\(P\)-\(V\) 図上に描かれた曲線と横軸に挟まれた領域の面積を表していることが分かるでしょう。

仕事を面積として見ることによってサイクルで得られる正味の仕事を視覚的に理解できるようになります。
実際にカルノーサイクルによって熱力学系がする仕事を図解してみましょう。
注意しておきますが、系が外界にする仕事は膨張するときに正の値を取り、逆に外から圧縮されるときに負の値を取ります。
分かり易さのために、膨張時の仕事は青色で、圧縮時の仕事は赤色で \(P\)-\(V\) 図上に表現することにしましょう。


図中の区間AB、区間BCは膨張過程で、一方で区間CD、区間DAは圧縮過程です。
これら2つの図を比較したとき、青色と赤色の重なる領域はそれぞれが打ち消し合って 0 となります。
つまりサイクルを形成する曲線で囲まれた領域の面積は、正の仕事として残ることが分かるでしょう。

サイクルを形成する曲線に囲まれた領域の面積が仕事になることを理解してもらったところで、熱源が1つでは正の仕事が取り出せない理由をここでハッキリさせておきます。
熱源が1つとは、上記の説明で言うところの \(T_{\text{high}}\) と \(T_{\text{low}}\) が等しい値を持つ状況とも言えますので、サイクルによって囲まれる領域は潰され 0 となり、すなわち系が正味で外界にする仕事は 0 となってしまうのです。
実際に上記と同様に面積で考える方法からしても、1つの等温線上を準静的に行ったり来たりするとき、膨張時 ( 青 ) と圧縮時 ( 赤 ) でそれぞれ仕事が打ち消されることが分かるでしょう。


以上のようにして、サイクルによって熱力学系に正の仕事をさせるときには2つの熱源が必要であることが理解できたと思われます。
カルノーサイクルによって理想気体がする仕事
カルノーサイクルの概要を理解していただいたところで、シリンダーに封入した理想気体がする仕事について具体的に計算してみましょう。
各等温過程・断熱過程における仕事
カルノーサイクルは4つの過程から構成されており、それぞれ2つの等温準静的過程、2つの断熱準静的過程です。
以下では各過程細かく1つずつに焦点をあて、理想気体がどういった状態になっているのかを詳しく説明していきます。

再度各過程における変化を提示しておきます。
\[ (T_{\text{high}}; ~ V_{\text{A}}, ~ n) \xrightarrow{\text{iq}} (T_{\text{high}}; ~ V_{\text{B}}, ~ n) \xrightarrow{\text{aq}} (T_{\text{low}}; ~ V_{\text{C}}, ~ n) \\[15pt] \xrightarrow{\text{iq}} (T_{\text{low}}; ~ V_{\text{D}}, ~ n) \xrightarrow{\text{aq}} (T_{\text{high}}; ~ V_{\text{A}}, ~ n) \]
※矢印の上に付いた「iq」は等温準静的を表す quasi-static isothermal の頭文字から、「aq」は断熱準静的を表す quasi-static adiabatic の頭文字から来ています。
区間AB 等温膨張過程 \((T_{\text{high}}; ~ V_{\text{A}}, ~ n) \xrightarrow{\text{iq}} (T_{\text{high}}; ~ V_{\text{B}}, ~ n)\)
区間ABでは高温熱源 \(T_{\text{high}}\) を系に接触させた状態で体積を \(V_{\text{A}}\) から \(V_{\text{B}}\) にまで膨張させます。
ピストンのハンドルを静かに引くことによって系内部の平衡状態を保ちながら準静的に操作します。
このときの理想気体による等温最大仕事は式(2)から次のように計算できます。
\[ \begin{align*} W_{\text{max}}(T_{\text{high}}; ~ V_{\text{A}} \rightarrow V_{\text{B}}) &= \int_{V_{\text{A}}}^{V_{\text{B}}} P dV \\[15pt] &= \int_{V_{\text{A}}}^{V_{\text{B}}} \frac{nRT_{\text{high}}}{V} dV = nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}} > 0 \end{align*} \]
計算には理想気体の状態方程式 \(PV = nRT\) を適用しています。
\(V_{\text{A}} < V_{\text{B}}\) であることから等温最大仕事は正であることが確かめられるでしょう。
区間BC 断熱膨張過程 \((T_{\text{high}}; ~ V_{\text{B}}, ~ n) \xrightarrow{\text{aq}} (T_{\text{low}}; ~ V_{\text{C}}, ~ n)\)
区間BCでは熱源には接触させずシリンダーを断熱壁で覆い外界との熱のやり取りを断った状態で、静かにピストンを操作して体積を \(V_{\text{B}}\) から \(V_{\text{C}}\) まで変化させます。
断熱変化では操作前後で系内部の温度が変化します。そして温度は系の状態によってのみ決まるので私達が外から操作することはできません。
しかし理想気体において成立するポアソンの関係式を利用すれば体積変化に伴う温度変化もあらかじめ計算できます。したがって系の温度をちょうど \(T_{\text{high}}\) から \(T_{\text{low}}\) に変化させる \(V_{\text{B}}\) および \(V_{\text{C}}\) を割り出すことができます。
実際に要件を満たす断熱準静的操作を行ったとして、そのときに系がする最大仕事を求めましょう。断熱操作の場合では式(2)を利用するよりも、次に示す熱力学第一法則を利用するのが非常に簡単です。
\[ \Delta U = -W_{\text{ad}} ~~~ ( ~ Q = 0 ~ ) \]
断熱条件下において仕事 \(W\) は式(4)の通り内部エネルギー変化 \(\Delta U\) によって記述されます。内部エネルギーは状態量なので操作前後の値が分かれば直ちに求めることができます。
更に理想気体においては内部エネルギーは温度のみの関数であることを思い出しましょう。
\[ \Delta U = C_V \Delta T \]
ここで \(C_V\) は定積熱容量で理想気体の場合は定数です。つまり式(5)から内部エネルギー変化は操作前後の温度差によって一意に定まることが分かります。
※理想気体における内部エネルギー変化が温度のみに依存する理由はこちらで解説
区間BCでは操作前後の温度変化が \(\Delta T = T_{\text{low}} - T_{\text{high}} < 0\) であるので、したがって式(4)および式(5)から系がした断熱最大仕事は次式で表されることが分かります。
\[ W_{\text{ad}}((T_{\text{high}}; ~ V_{\text{B}}, ~ n) \rightarrow (T_{\text{low}}; ~ V_{\text{C}}, ~ n)) = C_V (T_{\text{high}} - T_{\text{low}}) > 0 \]
膨張過程であるので、仕事は正の値をとることが確かめられます。
区間CD 等温圧縮過程 \((T_{\text{low}}; ~ V_{\text{C}}, ~ n) \xrightarrow{\text{iq}} (T_{\text{low}}; ~ V_{\text{D}}, ~ n)\)
区間CDでは内部の温度と等しい熱源 \(T_{\text{low}}\) に接触させながら体積を \(V_{\text{C}}\) から \(V_{\text{D}}\) にまで圧縮させます。
これまでとは逆にピストンのハンドルを静かに押し込むことによって系内部の平衡状態を保ちながら準静的に操作します。
このときの理想気体による等温最大仕事は式(3)同様に考えれば次のようになります。
\[ \begin{align*} W_{\text{max}}(T_{\text{low}}; ~ V_{\text{C}} \rightarrow V_{\text{D}}) &= \int_{V_{\text{C}}}^{V_{\text{D}}} P dV \\[15pt] &= nRT_{\text{low}} \ln{\frac{V_{\text{D}}}{V_{\text{C}}}} < 0 \end{align*} \]
\(V_{\text{C}} > V_{\text{D}}\) であることから等温最大仕事は負を取ります。
区間DA 断熱圧縮過程 \((T_{\text{low}}; ~ V_{\text{D}}, ~ n) \xrightarrow{\text{aq}} (T_{\text{high}}; ~ V_{\text{A}}, ~ n)\)
区間DAではシリンダーを断熱壁で覆った状態で静かにピストンを操作して体積を \(V_{\text{D}}\) から \(V_{\text{A}}\) まで変化させます。
区間BCでの議論同様に熱力学第一法則から簡単に仕事量を求めることができて、操作前後の温度変化 \(\Delta T = T_{\text{high}} - T_{\text{low}} > 0\) を式(5)に代入して
\[ W_{\text{ad}}((T_{\text{low}}; ~ V_{\text{D}}, ~ n) \rightarrow (T_{\text{high}}; ~ V_{\text{A}}, ~ n)) = C_V (T_{\text{low}} - T_{\text{high}}) < 0 \]
式(8)のとおり負の値をとり、圧縮過程における仕事を表現できていることが確かめられます。
正味の仕事量
前項で示した4つの過程における仕事すべての和を考えれば、カルノーサイクルによる正味の仕事を算出することができます。
実際に計算をしたものが次の式。
\[ \begin{align*} W_{\text{cyc}} \equiv ~ & W_{\text{max}}(T_{\text{high}}; ~ V_{\text{A}} \rightarrow V_{\text{B}}) + W_{\text{ad}}((T_{\text{high}}; ~ V_{\text{B}}, ~ n) \rightarrow (T_{\text{low}}; ~ V_{\text{C}}, ~ n)) \\[15pt] & + ~ W_{\text{max}}(T_{\text{low}}; ~ V_{\text{C}} \rightarrow V_{\text{D}}) + W_{\text{ad}}((T_{\text{low}}; ~ V_{\text{D}}, ~ n) \rightarrow (T_{\text{high}}; ~ V_{\text{A}}, ~ n)) \\[15pt] = ~ & nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}} ~ + ~ C_V (T_{\text{high}} - T_{\text{low}}) ~ + ~ nRT_{\text{low}} \ln{\frac{V_{\text{D}}}{V_{\text{C}}}} ~ + ~ C_V (T_{\text{low}} - T_{\text{high}}) \\[15pt] = ~ & nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}} ~ + ~ nRT_{\text{low}} \ln{\frac{V_{\text{D}}}{V_{\text{C}}}} \end{align*} \]
熱力学系がサイクルを一周するときに外界へする仕事を \(W_{\text{cyc}}\) と表現しました。
式(9)は次に示す体積と温度に関するポアソンの関係式を用いれば、もう少し簡潔な表現にすることができます。
\[ TV^{\gamma - 1} = T'V'^{ ~ \gamma - 1} ~~~ \left(~ \gamma = \frac{\bar{C}_V + R}{\bar{C}_V}, ~ \bar{C}_V = \frac{C_V}{n}~\right) \]
式(10)の関係は \((T; ~ V, ~ n) \xrightarrow{\text{aq}} (T'; ~ V', ~ n)\) という断熱準静的操作において成立することを念頭に置いて、
\((T_{\text{high}}; ~ V_{\text{B}}, ~ n) \xrightarrow{\text{aq}} (T_{\text{low}}; ~ V_{\text{C}}, ~ n)\) および \((T_{\text{low}}; ~ V_{\text{D}}, ~ n) \xrightarrow{\text{aq}} (T_{\text{high}}; ~ V_{\text{A}}, ~ n)\) の場合を考えると次式が成立することが分かります。
\[ \begin{align*} T_{\text{high}}V_{\text{B}}^{ ~ \gamma - 1} &= T_{\text{low}}V_{\text{C}}^{ ~ \gamma - 1} \\[15pt] T_{\text{low}}V_{\text{D}}^{ ~ \gamma - 1} &= T_{\text{high}}V_{\text{A}}^{ ~ \gamma - 1} \end{align*} \]
更に式(11)から…
\[ \frac{T_{\text{high}}}{T_{\text{low}}} = \left(\frac{V_{\text{D}}}{V_{\text{A}}}\right)^{~ \gamma - 1} = \left(\frac{V_{\text{C}}}{V_{\text{B}}}\right)^{~ \gamma - 1} \\[15pt] \Rightarrow ~ \frac{V_{\text{D}}}{V_{\text{A}}} = \frac{V_{\text{C}}}{V_{\text{B}}} \\[15pt] \therefore ~ \frac{V_{\text{A}}}{V_{\text{B}}} = \frac{V_{\text{D}}}{V_{\text{C}}} \]
が得られます。
したがって式(12)を式(9)に代入して整理すると次式のようになります。
\[ \begin{align*} W_{\text{cyc}} &= nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}} ~ + ~ nRT_{\text{low}} \ln{\frac{V_{\text{D}}}{V_{\text{C}}}} \\[15pt] &= nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}} ~ + ~ nRT_{\text{low}} \ln{\textcolor{red}{\frac{V_{\text{A}}}{V_{\text{B}}}}} \\[15pt] &= nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}} ~ \textcolor{red}{-} ~ nRT_{\text{low}} \ln{\textcolor{red}{\frac{V_{\text{B}}}{V_{\text{A}}}}} \\[15pt] &= nR(T_{\text{high}} - T_{\text{low}}) \ln{\frac{V_{\text{B}}}{V_{\text{A}}}} > 0 \end{align*} \]
計算結果からも伺える通り、カルノーサイクルによって系がする正味の仕事が正の値を取り、仕事が取り出せていることが分かります。
以上、カルノーサイクルの各過程において理想気体がする仕事を計算してきました。
再度以下に表にしてまとめたものを示しておきましょう。
| 操作 | \(W_{\text{max}}\) | \(Q_{\text{max}}\) | \(\Delta U\) |
|---|---|---|---|
| 等温圧縮(A→B) | \(nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}\) | \(nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}\) | \(0\) |
| 断熱膨張(B→C) | \(C_V (T_{\text{high}} - T_{\text{low}})\) | \(0\) | \(- C_V (T_{\text{high}} - T_{\text{low}})\) |
| 等温圧縮(C→D) | \(- nRT_{\text{low}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}\) | \(- nRT_{\text{low}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}\) | \(0\) |
| 断熱圧縮(D→A) | \(- C_V (T_{\text{high}} - T_{\text{low}})\) | \(0\) | \(C_V (T_{\text{high}} - T_{\text{low}})\) |
表中には最大吸熱量 \(Q_{\text{max}}\) と内部エネルギー変化 \(\Delta U\) も合わせて記載しておきました。
これらは理想気体において成立する熱力学第一法則を利用して算出しています。
- 等温過程 : \(0 = -W_{\text{max}} + Q_{\text{max}}\)
- 断熱過程 : \(\Delta U = -W_{\text{ad}}\)
ただしこれら仕事と熱の符号には注意して下さい。系が外界に仕事をするとき \(W_{\text{max}}\) は正の値を取り、また系が外部環境から熱を吸収するとき \(Q_{\text{max}}\) に正の値をとります。
熱効率
カルノーサイクルによって熱力学系から外界へ正の仕事を取りだすためには、高温熱源と低温熱源の2つが必要であることを示してきました。
熱力学系は熱源との間で熱のやり取りを行い、サイクルを通して吸熱と放熱を行います。
理想気体で作業する場合だと前節の最後で示した通り \(nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}\) の熱を吸収し、\(nRT_{\text{low}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}\) の熱を逃がす事になります。
願わくは熱力学系が吸収した熱すべてを仕事に変換したいところなのですが、サイクルの途中で熱を捨てていることからも伺えるように、実は吸収した熱の一部分しか仕事として利用できないのです。
このように高温熱源から吸収した熱に対して、熱力学系がどのくらい仕事をしてくれるのか数値化したものを熱効率と言います。
熱効率 \(\eta\) は熱力学系が高温熱源から吸収した熱 \(Q_{\text{in}}\) に対する、仕事 \(W_{\text{cyc}}\) として次式で定められます。
\[ \eta = \frac{W_{\text{cyc}}}{Q_{\text{in}}} \]
\(W_{\text{cyc}}\) は前節で導いた結果を用いればよく、\(Q_{\text{in}}\) は前述の通り \(nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}\) であるので、実際に代入すれば次式を得ることができます。
\[ \begin{align*} \eta = \frac{nR(T_{\text{high}} - T_{\text{low}}) \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}}{nRT_{\text{high}} \ln{\frac{V_{\text{B}}}{V_{\text{A}}}}} &= \frac{T_{\text{high}} - T_{\text{low}}}{T_{\text{high}}} \\[15pt] \therefore ~ \eta &= 1 - \frac{T_{\text{low}}}{T_{\text{high}}} < 1 \end{align*} \]
式(15)の結果が示すとおり、カルノーサイクルで理想気体を用いたとき、その熱効率は2つの熱源の温度のみに依存することが分かります。
熱効率を大きくして、より大きな仕事を得るには \(\frac{T_{\text{low}}}{T_{\text{high}}}\) の項を小さくすれば良いでしょう。
そのためには低温熱源の温度を 0 に近づけるか、より高い温度の熱源を用意することが要求されます。
低温熱源を絶対零度 ( \(T_{\text{low}} = 0\) ) にすれば理論的には熱効率を100%にできますが、技術的な問題でそもそも絶対零度の実現が困難を極めるそうです…。
つまりカルノーサイクルで熱効率を100%にすることは非現実的なのです。
繰り返しにはなりますが、これは言い換えると吸収した熱をすべて仕事に変換することは不可能であり、必ずロスを生じるという事を意味します。そのロスとは、すなわちここでは放熱を指しているわけです。
まとめ
当ページでは熱力学系から正の仕事を取りだすことを考えました。
正の仕事とは、すなわち系の体積が膨張し外界へ力を及ぼすことを指します。
単に1回だけ外界に仕事をさせるのではなく、何度も繰り返し仕事が取り出せると便利です。
その際ポイントとなるのは温度の異なる2つの熱源です。
熱力学系は体積が膨張する過程で高温熱源から熱を吸収し、体積が圧縮される過程で低温熱源へ熱を逃がします。
この一連の過程を経たとき系がした正味の外界への仕事は正となるのです。
具体的には2つの等温操作と、2つの断熱操作を用いてグルっと一周できるような操作経路を考えます。

この経路を一周させれば系内部の状態は最初と全く同じ状態に戻すことができ、そのような過程をサイクルと呼びます。
そして上記のような等温操作と断熱操作を用いたサイクルを、考案者にちなんでカルノーサイクルと呼びます。
熱力学系は外部環境から吸収した熱を利用し、それを仕事に変換することで外部に影響を及ぼすことができます。
ただし同時に低温の熱源へいくらかの熱を逃がす必要があり、吸収したすべての熱を仕事に変換できないことが分かります。
熱力学系がサイクルを一周する際、高温熱源から吸収した熱 \(Q_{\text{in}}\) に対してどのくらいの仕事 \(W_{\text{cyc}}\) をするかを数値化した熱効率 \(\eta\) を定義するのが便利です。
\[ \eta = \frac{W_{\text{cyc}}}{Q_{\text{in}}} \]
理想気体に対してカルノーサイクルによる操作を行ったとき、その熱効率は高温熱源と低温熱源の温度、それぞれ \(T_{\text{high}}\)、\(T_{\text{low}}\) のみで表現することが可能で次式で表現されます。
\[ \eta = 1 - \frac{T_{\text{low}}}{T_{\text{high}}} \]
この式から分かる通り、熱効率は 1 以下の値を取ります。
理想気体から得られる仕事を大きくする、すなわち熱効率を高めるにはより高い高温熱源を用意することが要求されます。
【サイト運営 : だいご】
今年で物理化学歴12年目になります。
大学入試2次数学でたった3割しか得点できなかったいわゆる数弱落ちこぼれ。それでも好きこそものの上手なれと言ったところか、学会で最優秀賞受賞したり首席卒業できてしまったので、役に立つ知識を当サイトに全て惜しみなく公開しようと思います。ブックマークをオススメ。

