\(n ~ [\text{mol}]\) の気体が封入された容器の一部に小さな穴を開けてしばらくすると、容器内の気体は次第に外へ逃げていきます。
このように物質は今ある状態から別の状態へ移り変わろうとする性質を持ちます。
当ページでは化学ポテンシャルと呼ばれる熱力学量を定義し、それを用いた状態の移り変わりの理解に迫ります。
■このページで分かる内容のまとめ■
物質量を変化させたときのギブス自由エネルギー変化について、その極限である偏微分係数を化学ポテンシャル \(\mu(T, ~ P)\) と定義します。
\[ \mu(T, ~ P) \equiv \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} \]
系を構成する物質が1種類の場合、化学ポテンシャルは物質 1 \([\text{mol}]\) あたりのギブス自由エネルギーとして理解することができます。
\[ \mu = \frac{G}{n} \]
また化学ポテンシャルは温度依存性および圧力依存性をもち、それぞれ次の関係が成立しています。
\[ \left( \frac{\partial \mu}{\partial T} \right)_P = -\bar{S} \]
\[ \left( \frac{\partial \mu}{\partial P} \right)_T = \bar{V} \]
ここで \(\bar{S}\)、\(\bar{V}\) はそれぞれ系を構成する物質 1 \([\text{mol}]\) あたりのエントロピーおよび体積を表します。
■目次■
化学ポテンシャルの定義
化学ポテンシャルは記号を \(\mu\) として次式で与えられます。
\[ \mu \equiv \lim_{\Delta n \rightarrow 0} \frac{\Delta G}{\Delta n} = \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} \]
\(G\) はギブス自由エネルギーで、それと物質量の変化率の極限を考えます。要するに化学ポテンシャルはギブス自由エネルギーの物質量に関する偏微分係数のことです。
式(1)を見れば、ギブス自由エネルギーを物質量で偏微分する際に、温度 \(T\) と圧力 \(P\) を固定していることが分かります。これはギブス自由エネルギーが \(G(T, ~ P; ~ n)\) のように温度、圧力、物質量を変数に持つためです。
化学ポテンシャルの意味
1モルあたりのギブス自由エネルギー
化学ポテンシャルは物質 1 \([\text{mol}]\) あたりのギブス自由エネルギーとして理解することができます。数学的に表すと次の通りです。
\[ \mu = \frac{G}{n} \]
まるで定義式(1)から \(\partial\) が取れた物であるかのようですが、この関係は次に示すオイラーの関係式から導かれます。( より重要な概念を次項で示すので読み飛ばしても問題ありません。 )
\[ A(\boldsymbol{Y}; \boldsymbol{X}) = \sum_{i = 1}^r x_i \left( \frac{\partial A}{\partial x_i} \right)_{\boldsymbol{Y}, ~ x_{j\char`≠i}} \]
ここで \(\boldsymbol{X}\) は示量変数の組 \((x_1, ~ x_2 ~ \cdots ~ x_r)\)、\(\boldsymbol{Y}\) は示強変数の組 \((y_1, ~ y_2 ~ \cdots ~ y_s)\) を表しています。
オイラーの関係式(3)は、ある熱力学量 \(A\) がもつ各示量変数 \(x_1, ~ x_2 ~ \cdots ~ x_r\) で自分自身を偏微分し、それと変数との積 ( 全 \(r\) 項 ) を足し合わせたものです。
そして実際にギブス自由エネルギー \(G(T, ~ P; ~ n)\) に対してオイラーの関係式(3)を適用させると次式が得られます。
\[ G(T, ~ P; ~ n) = n \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} = n \mu \]
したがって化学ポテンシャル \(\mu\) について解けば、直ちに式(2) \(\mu = \frac{G}{n}\) が導かれる事が分かるでしょう。
物質移動
化学ポテンシャルは物質 1 \([\text{mol}]\) あたりのギブス自由エネルギーとしても理解できますが、より本質的な理解がここで解説する物質移動です。
その概念を捉えるために気体が封入された次のような容器を考えます。
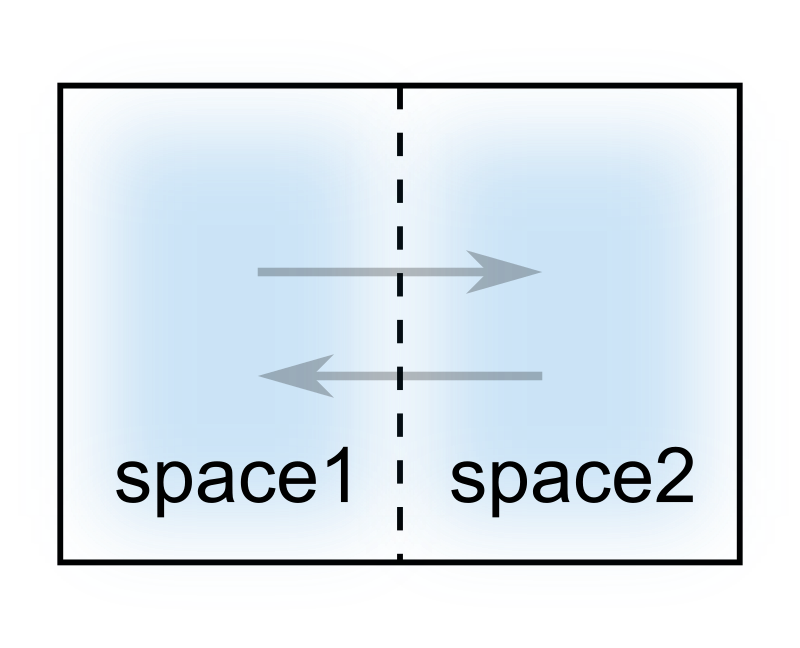
容器の中央を仕切るのは半透膜と呼ばれる小さな穴が空いた膜で、その穴を貫通して気体は各部屋を行き来することができます。
またこの模型は、ちょうど冒頭で話した穴を開けた容器から気体が外へ逃げていく状況を小スケールにしたものになります。
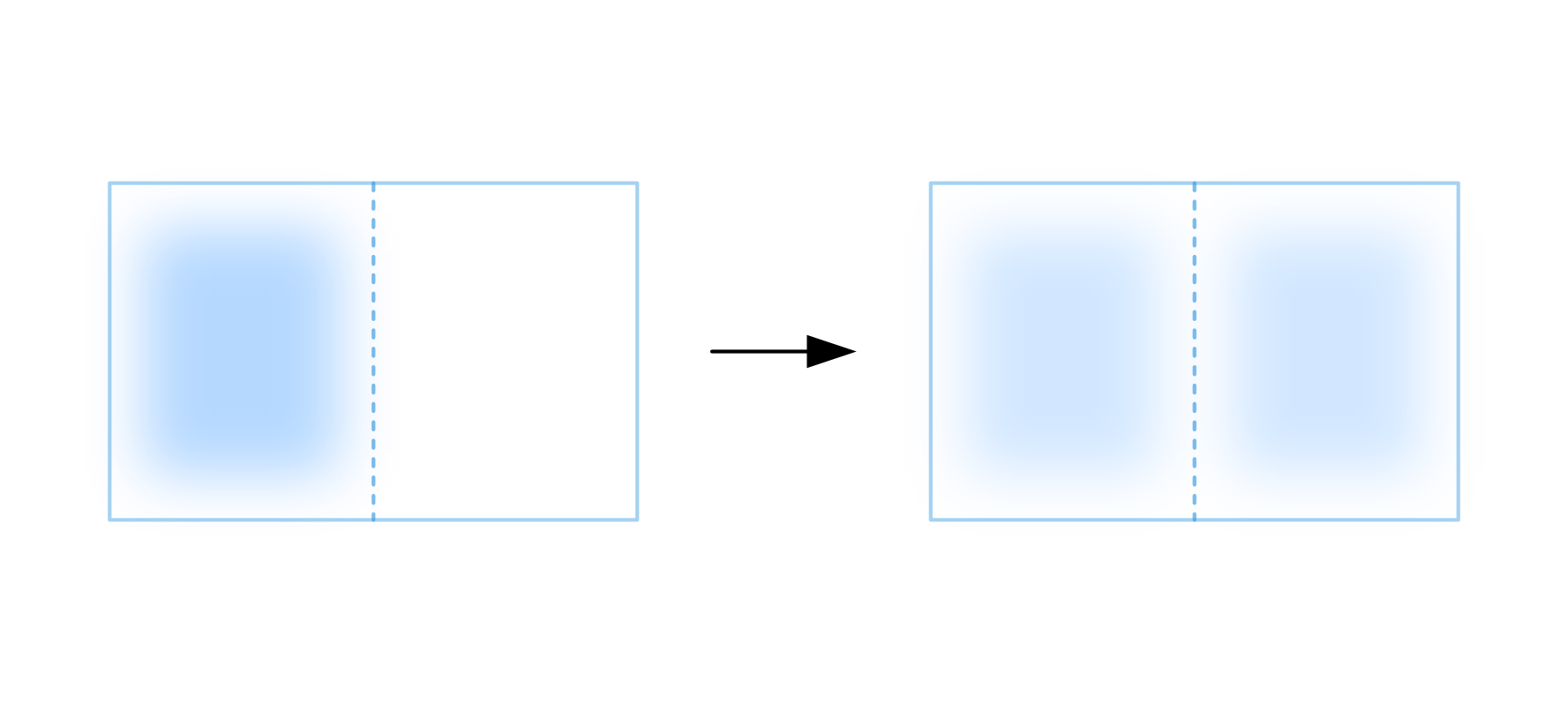
部屋1に気体が封入された状況を初期状態として、仕切りを半透膜に置き換えると気体はもう片方の部屋に移動し始めます。このとき部屋2が先の例の容器外側に相当しています。
ただし部屋2は有限の体積しか持たないために、部屋1から気体が完全に失くなる前に物質移動は止まり平衡状態に到達します。
各部屋の気体の物質量変化に着目して平衡条件を求めてみましょう。( エントロピーを利用した平衡条件の導出を解説したページも参考にどうぞ。 )
平衡状態では見かけ上 系に変化が見られませんが、実際は部屋1と部屋2で平衝点から大きくずれない程度の微小な物質量の揺らぎ \(\delta n_1\), \(\delta n_2\) が生じています。
揺らぎが小さければ元の状態に戻ることができると考えられるので、揺らぐ前後の状態でギブス自由エネルギーは等しくなります。
\[ G\big( (T, ~ P; ~ n_1), ~ (T, ~ P; ~ n_2) \big) = G\big( (T, ~ P; ~ n_1 + \delta n_1), ~ (T, ~ P; ~ n_2 + \delta n_2) \big) \]
ギブス自由エネルギーの相加性を用いれば、式(5)両辺の複合ギブス自由エネルギーは各部屋におけるギブス自由エネルギーの和として表すことができます。
\[ G_1(T, ~ P; ~ n_1) + G_2(T, ~ P; ~ n_2) = G_1(T, ~ P; ~ n_1 + \delta n_1) + G_2(T, ~ P; ~ n_2 + \delta n_2) \]
式(6)右辺の項についてテイラー1次近似によって展開すると
\[ \begin{align*} G_1(T, ~ P; ~ n_1 + \delta n_1) &= G_1(T, ~ P; ~ n_1) + \left( \frac{\partial G_1(T, ~ P; ~ n_1)}{\partial n} \right)_{T, ~ P} \delta n_1 \\[15pt] &= G_1(T, ~ P; ~ n_1) + \mu_1 \delta n_1 \\[15pt] G_2(T, ~ P; ~ n_2 + \delta n_2) &= G_2(T, ~ P; ~ n_2) + \left( \frac{\partial G_2(T, ~ P; ~ n_2)}{\partial n} \right)_{T, ~ P} \delta n_2 \\[15pt] &= G_2(T, ~ P; ~ n_2) + \mu_2 \delta n_2 \end{align*} \]
となります。ここで \(\mu_1\), \(\mu_2\) はそれぞれ部屋1および部屋2の化学ポテンシャルです。
そして式(7)を式(6)に戻して整理すると次式が得られます。
\[ \mu_1 \delta n_1 + \mu_2 \delta n_2 = 0 \]
ここで容器中の気体の総物質量は一定に保存されており、つまり物質量の揺らぎの和は 0 となります。
\[ \delta n_1 + \delta n_2 = 0 \]
すると式(8)は次にように書き換えることができます。
\[ (\mu_1 - \mu_2) \delta n_1 = 0 \]
物質量の揺らぎ \(\delta n_1\) の大きさに関係なく式(10)の成立する必要があるので、結果 平衡条件は各部屋の気体の化学ポテンシャルが等しくなる事と理解できます。
\[ \mu_1 = \mu_2 \]
各部屋の化学ポテンシャルが一致しないとき、系は非平衡状態となり一方の部屋から他方の部屋へ物質の移動が起こります。
その変化前後における部屋1および部屋2の状態が次の表に示すとおりであったとしましょう。
| 部屋1 | 部屋2 | |
|---|---|---|
| 始状態 | \((T_1, ~ P_1; ~ n_1)\) | \((T_2, ~ P_2; ~ n_2)\) |
| 終状態 | \((T_1, ~ P_1; ~ n_1 + \Delta n_1)\) | \((T_2, ~ P_2; ~ n_2 + \Delta n_2)\) |
系が状態を変化させる際に非平衡状態となる場合、ギブス自由エネルギーは始めより小さくなるので、次の関係が成立します。
\[ G\big( (T_1, ~ P_1; ~ n_1), ~ (T_2, ~ P_2; ~ n_2) \big) > G\big( (T_1, ~ P_1; ~ n_1 + \Delta n_1), ~ (T_2, ~ P_2; ~ n_2 + \Delta n_2) \big) \]
複合系のギブス自由エネルギーは各部屋のギブス自由エネルギーの和と等しいので、式(12)は次のように書き換えられます。
\[ G_1(T_1, ~ P_1; ~ n_1) + G_2(T_2, ~ P_2; ~ n_2) > G_1(T_1, ~ P_1; ~ n_1 + \Delta n_1) + G_2(T_2, ~ P_2; ~ n_2 + \Delta n_2) \]
式(13)右辺の項をテイラー1近似によって展開すると
\[ \begin{align*} G_1(T_1, ~ P_1; ~ n_1 + \Delta n_1) &\simeq G_1(T_1, ~ P_1; ~ n_1) + \left( \frac{\partial G_1(T_1, ~ P_1; ~ n_1)}{\partial n} \right)_{T, ~ P} \Delta n_1 \\[15pt] &= G_1(T_1, ~ P_1; ~ n_1) + \mu_1 \Delta n_1 \\[15pt] G_2(T_2, ~ P_2; ~ n_2 + \Delta n_2) &\simeq G_2(T_2, ~ P_2; ~ n_2) + \left( \frac{\partial G_2(T_2, ~ P_2; ~ n_2)}{\partial n} \right)_{T, ~ P} \Delta n_2 \\[15pt] &= G_2(T_2, ~ P_2; ~ n_2) + \mu_2 \Delta n_2 \end{align*} \]
となるので、式(13)に戻して整理すると次式を得られます。
\[ \mu_1 \Delta n_1 + \mu_2 \Delta n_2 < 0 \]
容器中の気体の総物質量は一定なので、各部屋の物質量変化の和は 0 になります。
\[ \Delta n_1 + \Delta n_2 = 0 \]
式(15)と式(16)から \(\Delta n_2\) を消去すると次の関係が導かれます。
\[ (\mu_1 - \mu_2) \Delta n_1 < 0 \]
いま各部屋の化学ポテンシャルが \(\mu_1 > \mu_2\) である場合、部屋1の物質量変化は \(\Delta n_1 < 0\) となり、要するに部屋2へ物質が移動する事を示しています。
逆に \(\mu_1 < \mu_2\) であれば \(\Delta n_1 > 0\) なので、部屋2から部屋1へ物質の移動が生じることが分かります。
以上から、化学ポテンシャルが物質移動を記述する熱力学量であることを理解できるでしょう。
化学ポテンシャルの示強性
定義式(1)から化学ポテンシャルは変数に温度 \(T\)、圧力 \(P\)、物質量 \(n\) を持つと考えられますが、物質量には依存しない量であることが分かります。
それを示すにはギブス自由エネルギーの示量性を用いればよく
\[ \mu = \frac{G(T, ~ P; \lambda n)}{\lambda n} = \frac{\lambda G(T, ~ P; ~ n)}{\lambda n} = \frac{G(T, ~ P; ~ n)}{n} \]
と言ったように、物質量を \(\lambda\) 倍したとしても、ちょうど分母・分子で打ち消し合います。
このように物質量に依存しない性質を示強性と呼びます。
以降、化学ポテンシャルの変数を表示する際は \(\mu(T, ~ P)\) と記述することにします。
化学ポテンシャルの温度依存性・圧力依存性
化学ポテンシャル \(\mu(T, ~ P)\) の温度依存性および圧力依存性はどのように記述されるか求めてみましょう。
まず式(4)で与えられる \(G = n\mu\) を両辺微分して次式を得ます。
\[ dG = d(n \mu) = \mu dn + n d\mu \]
ギブス自由エネルギーの全微分 \(dG\) は
\[ \begin{align*} \text{eq(20.1) :} ~~~~~ &dG(T, ~ P; ~ n) = \left( \frac{\partial G}{\partial T} \right)_{P, ~ n} dT + \left( \frac{\partial G}{\partial P} \right)_{T, ~ n} dP + \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} dn \\[20pt] \text{eq(20.2) :} ~~~~~ &\therefore ~ dG = -S dT + V dP + \mu dn \end{align*} \]
となるので、式(19)と式(20.2)から \(dG\) を消去して整理したものが次式です。
\[ d\mu = \bar{V} dP - \bar{S} dT ~~~ \left( ~ \bar{V} \equiv \frac{V}{n}, ~ \bar{S} \equiv \frac{S}{n} ~ \right) \]
ここで \(\bar{V}\), \(\bar{S}\) はそれぞれモル体積およびモルエントロピーと呼ばれ、物質 1 \([\text{mol}]\) あたりの体積およびエントロピーを表します。
化学ポテンシャル \(\mu(T, ~ P)\) の全微分は、
\[ d\mu = \left( \frac{\partial \mu}{\partial P} \right)_{T} dP + \left( \frac{\partial \mu}{\partial T} \right)_{P} dT \]
で与えられるので、式(21)と比較すると化学ポテンシャルの温度依存性・圧力依存性が次式で与えられることが分かります。
\[ \left( \frac{\partial \mu}{\partial T} \right)_P = - \bar{S} \]
\[ \left( \frac{\partial \mu}{\partial P} \right)_T = \bar{V} \]
理想気体の化学ポテンシャル
理想気体の化学ポテンシャルを求めてみましょう。
温度 \(T\)、圧力 \(P\) の条件にある物質量 \(n\) の理想気体のギブス自由エネルギーが
\[ G(T, ~ P; ~ n) = nRT - nRT \ln \bigg[ \left( \frac{T}{T_0} \right)^{\alpha + 1} \frac{P^\circ}{P} \bigg] + U(T, ~ P^\circ; ~ n) - TS(T_0, ~ P^\circ; ~ n) \]
で与えられることから、式(4)に沿って計算すると化学ポテンシャルが得られます。
\[ \mu(T, ~ P) = \frac{G}{n} = RT - RT \ln \bigg[ \left( \frac{T}{T_0} \right)^{\alpha + 1} \frac{P^\circ}{P} \bigg] + \bar{U}(T, ~ P^\circ) - T\bar{S}(T_0, ~ P^\circ) ~~~ \left( ~ \bar{U} = \frac{U}{n}, ~ \bar{S} = \frac{S}{n} ~ \right) \]
\(T_0\), \(P^\circ\) は標準状態における温度および圧力を表し、また \(\bar{U}\)、\(\bar{S}\) はそれぞれ理想気体 1 \([\text{mol}]\) あたりの内部エネルギーおよびエントロピーを表しています。
式(26) \(\mu(T, ~ P)\) は、標準状態 \((T_0, ~ P^\circ)\) を基準として温度と圧力を \((T, ~ P)\) にしたときの化学ポテンシャルです。
ここでは基準を標準状態に取っていますが、任意の温度圧力条件を基準としても問題ありません。
\(T_0 = T\) とすると、温度を一定にして圧力を \(P\) にしたときの化学ポテンシャルが得られます。
\[ \mu(T, ~ P) = RT + RT \ln \frac{P}{P^\circ} + \bar{U}(T, ~ P^\circ) - T \bar{S}(T, ~ P^\circ) \]
また標準圧力下における化学ポテンシャル \(\mu(T, ~ P^\circ)\) は次式で与えられます。
\[ \begin{align*} \mu(T, ~ P^\circ) &= \frac{G(T, ~ P^\circ; ~ n)}{n} \\[15pt] &= \frac{1}{n}\Big( U(T, ~ P^\circ; ~ n) + P^\circ V(T, ~ P^\circ; ~ n) - T S(T, ~ P^\circ; ~ n) \Big) \\[20pt] &= \bar{U}(T, ~ P^\circ) + RT - T\bar{S}(T, ~ P^\circ) \end{align*} \]
式(28)は展開途中でギブス自由エネルギーの定義式 \(G = U + PV - TS\) および、理想気体の状態方程式 \(P^\circ V(T, ~ P^\circ; ~ n) = nRT\) を利用しました。
式(28)から、式(27)を整理すると次式が得られます。
\[ \mu(T, ~ P) = \mu(T, ~ P^\circ) + RT \ln \frac{P}{P^\circ} \]
また式(29)は、化学ポテンシャルの圧力依存性の式(24)からも導くことが可能です。
式(24)の両辺を \(P^\circ\) から \(P\) で積分すればよく
\[ \begin{align*} \text{eq(24) :} ~~~~~ \left( \frac{\partial \mu}{\partial P} \right)_T &= \bar{V} \\[15pt] \int_{P^\circ}^P \left( \frac{\partial \mu}{\partial P} \right)_T dP &= \int_{P^\circ}^P \frac{RT}{P} dP \\[20pt] \therefore ~ \mu(T, ~ P) &= \mu(T, ~ P^\circ) + RT \ln \frac{P}{P^\circ} ~~~ \big( ~ = \text{eq(29)} ~ \big) \end{align*} \]
となります。
このとき理想気体のモル体積が \(\bar{V} = \frac{RT}{P}\) となることを利用しています。
化学ポテンシャルと熱力学関数
化学ポテンシャルはギブス自由エネルギーの物質量に関する偏微分係数として定義式(1)で与えましたが、実は別の熱力学関数でも良いということを説明します。
要するに、化学ポテンシャルは
\[ \mu = \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} = \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} = \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} = \left( \frac{\partial H}{\partial n} \right)_{P, ~ S} \]
が成立します。
熱力学関数 \(G\), \(F\), \(U\), \(H\) の物質量に関する偏微分係数が全て等しく化学ポテンシャルとして表せることを確認するにあたり、まず完全な熱力学関数の全微分から調べてみましょう。
\[ \begin{align*} \text{eq(31.1) :} ~~~~~ &dG(T, ~ P; ~ n) = \left( \frac{\partial G}{\partial T} \right)_{P, ~ n} dT + \left( \frac{\partial G}{\partial P} \right)_{T, ~ n} dP + \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} dn \\[15pt] \text{eq(31.2) :} ~~~~~ &dF(T; ~ V, ~ n) = \left( \frac{\partial F}{\partial T} \right)_{V, ~ n} dT + \left( \frac{\partial F}{\partial V} \right)_{T, ~ n} dV + \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} dn \\[15pt] \text{eq(31.3) :} ~~~~~ &dU(S, ~ V, ~ n) = \left( \frac{\partial U}{\partial S} \right)_{V, ~ n} dS + \left( \frac{\partial U}{\partial V} \right)_{S, ~ n} dV + \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} dn \\[15pt] \text{eq(31.4) :} ~~~~~ &dH(P; ~ S, ~ n) = \left( \frac{\partial H}{\partial P} \right)_{S, ~ n} dP + \left( \frac{\partial H}{\partial S} \right)_{P, ~ n} dS + \left( \frac{\partial H}{\partial n} \right)_{P, ~ S} dn \end{align*} \]
熱力学関数の偏微分係数は
\[ \begin{align*} &\left( \frac{\partial G}{\partial T} \right)_{P, ~ n} = -S, && \left( \frac{\partial G}{\partial P} \right)_{T, ~ n} = V \\[15pt] &\left( \frac{\partial F}{\partial T} \right)_{V, ~ n} = -S, && \left( \frac{\partial F}{\partial V} \right)_{T, ~ n} = -P \\[15pt] &\left( \frac{\partial U}{\partial S} \right)_{V, ~ n} = T, && \left( \frac{\partial U}{\partial V} \right)_{S, ~ n} = -P \\[15pt] &\left( \frac{\partial H}{\partial P} \right)_{S, ~ n} = V, && \left( \frac{\partial H}{\partial S} \right)_{P, ~ n} = T \\[15pt] \end{align*} \]
であるから、式(31)は次のようになります。
\[ \begin{align*} \text{eq(33.1) :} ~~~~~ &dG(T, ~ P; ~ n) = -S dT + V dP + \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} dn \\[15pt] \text{eq(33.2) :} ~~~~~ &dF(T; ~ V, ~ n) = -S dT - P dV + \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} dn \\[15pt] \text{eq(33.3) :} ~~~~~ &dU(S, ~ V, ~ n) = T dS - P dV + \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} dn \\[15pt] \text{eq(33.4) :} ~~~~~ &dH(P; ~ S, ~ n) = V dP + T dS + \left( \frac{\partial H}{\partial n} \right)_{P, ~ S} dn \end{align*} \]
ギブス自由エネルギー \(G\) とヘルムホルツ自由エネルギー \(F\) の間には \(G = F + PV\) という関係があり、全微分を計算すると
\[ dG = dF + V dP + P dV \]
となります。
そして、式(34)に式(33.1)と式(33.2)を代入すると
\[ \begin{align*} \text{eq(34) :} ~~~~~ dG &= dF + V dP + P dV \\[15pt] -S dT + V dP + \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} dn &= \left\{ -S dT - P dV + \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} dn \right\} + V dP + P dV \\[30pt] \therefore ~ \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} &= \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} \end{align*} \]
このようにギブス自由エネルギーとヘルムホルツ自由エネルギーの物質量に関する偏微分係数が等しくなる結果が導かれます。
次にヘルムホルツ自由エネルギー \(F\) と内部エネルギー \(U\) については \(F = U - TS\) の関係があるので、直前の内容と同様に計算すると
\[ \begin{align*} dF &= dU - S dT - T dS \\[15pt] -S dT - P dV + \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} dn &= \left\{ T dS - P dV + \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} dn \right\} - S dT - T dS \\[30pt] \therefore ~ \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} &= \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} \end{align*} \]
となります。
更に内部エネルギー \(U\) とエンタルピー \(H\) については \(H = U + PV\) の関係があるので
\[ \begin{align*} dH &= dU + V dP + P dV \\[15pt] V dP + T dS + \left( \frac{\partial H}{\partial n} \right)_{P, ~ S} dn &= \left\{ T dS - P dV + \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} dn \right\} + V dP + P dV \\[30pt] \therefore ~ \left( \frac{\partial H}{\partial n} \right)_{P, ~ S} &= \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} \end{align*} \]
となります。
以上の内容から熱力学関数 \(G\), \(F\), \(U\), \(H\) の物質量に関する偏微分係数は全て等しいことを確認することができました。
\[ \mu = \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} = \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} = \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} = \left( \frac{\partial H}{\partial n} \right)_{P, ~ S} \]
しかし注意しなければならないのは、各熱力学関数を物質量 \(n\) で偏微分するときに固定している変数です。
完全な熱力学関数は各々で異なる変数をもつので、それに応じて次に示すように化学ポテンシャルの変数が反映されることになります。
\[ \begin{align*} &\mu(T, ~ P; ~ n) &&= \left( \frac{\partial G}{\partial n} \right)_{T, ~ P} ~~~ \big( ~ = \mu(T, ~ P) ~ \big)\\[15pt] &\mu(T; ~ V, ~ n) &&= \left( \frac{\partial F}{\partial n} \right)_{T, ~ V} \\[15pt] &\mu(S, ~ V, ~ n) &&= \left( \frac{\partial U}{\partial n} \right)_{S, ~ V} \\[15pt] &\mu(P; ~ S, ~ n) &&= \left( \frac{\partial H}{\partial n} \right)_{P, ~ S} \end{align*} \]
変数が異なるため一見別物のように思えますが、くり返し述べるようにこれらは全て等しい関係にあります。
\[ \mu(T, ~ P; ~ n) = \mu(T; ~ V, ~ n) = \mu(S, ~ V, ~ n) = \mu(P; ~ S, ~ n) \]
化学ポテンシャルとエントロピー
化学ポテンシャルはエントロピーとも関係があり次式で与えられることを確認できます。
\[ \mu = -T \left( \frac{\partial S}{\partial n} \right)_{U, ~ V} \]
前節までの内容から、内部エネルギーの全微分が次式で与えられることを利用します。
\[ dU = T dS - P dV + \mu dn \]
ここで式(41)を \(dS\) について解くと次のようになります。
\[ dS = \frac{1}{T} dU + \frac{P}{T} dV - \frac{\mu}{T} dn \]
式(42)はエントロピーの全微分であり、
\[ dS = \left( \frac{\partial S}{\partial U} \right)_{V, ~ n} dU + \left( \frac{\partial S}{\partial V} \right)_{U, ~ n} dV + \left( \frac{\partial S}{\partial n} \right)_{U, ~ V} dn \]
に等しいので、各微分 \(dU\), \(dV\), \(dn\) の係数を比較すれば次の関係式が得られます。
\[ \begin{align*} &\text{eq(44.1)} ~~~~~ \left( \frac{\partial S}{\partial U} \right)_{V, ~ n} = \frac{1}{T} \\[15pt] &\text{eq(44.2)} ~~~~~ \left( \frac{\partial S}{\partial V} \right)_{U, ~ n} = \frac{P}{T} \\[15pt] &\text{eq(44.3)} ~~~~~ \left( \frac{\partial S}{\partial n} \right)_{U, ~ V} = - \frac{\mu}{T} \end{align*} \]
式(44.3)を \(\mu\) について解けば、直ちに式(40)が導かれます。
【サイト運営 : だいご】
今年で物理化学歴13年目になります。
大学入試2次数学でたった3割しか得点できなかったいわゆる数弱落ちこぼれ。それでも好きこそものの上手なれと言ったところか、学会で最優秀賞受賞したり首席卒業できてしまったので、役に立つ知識を当サイトに全て惜しみなく公開しようと思います。ブックマークをオススメ。