割れたガラスは元に戻らないように、身の回りには不可逆な現象が存在します。
逆に、元の状態に戻すことができる可逆な現象も存在します。
これらの概念は簡単そうに見えますが…
実は可逆過程と不可逆過程とは断熱系に対して用いられるべき概念であるという認識はありますか?
またよく混同される概念として準静的過程がありますが、可逆過程との違いを理解していますか?
当ページでは可逆過程と不可逆過程とは何か、そしてどういった場面で利用するものかなど詳しく解説をしていきます!
可逆過程と不可逆過程
可逆過程
可逆過程とは、初期状態から変化した系を元に戻すことができる過程のことを言います。
例えば次の図のように、はじめ状態Aにある系を可逆的に状態Bにしたとき、系は状態図上のある経路をたどるように変化します。
その後、真逆の操作を行うことで同じ経路を逆方向にたどって状態Aまで戻ることができます。

また系を可逆的に変化させるとき、必ず準静的に操作する必要があり、状態Aと状態Bの間で行える操作を次のように書くことができます。
\[ (T_\text{A}; ~ V_\text{A}, ~ n) ~ \xleftrightarrow{\text{aq}} ~ (T_\text{B}; ~ V_\text{B}, ~ n) \]
矢印上部の「 aq 」は "断熱準静的" を英語で表した "quasi-static adiabatic" の頭文字を表しています。
断熱条件では、操作前後で系の温度が変化するという特徴があります。つまり \(T_\text{A} ~ \char`≠ ~ T_\text{B}\) であることに注意しましょう。
また準静的操作によって逆方向の操作が行えることはこちらで説明しているので参考にして下さい。
また準静的操作(1)では、左向きと右向きどちらの過程も系は外界に最大仕事をします。
最大仕事は \(P\) - \(V\) 図上に表される経路下の面積を計算すればよく、
いま左右どちら向きの操作も同じ経路をたどるので最大仕事の絶対値は等しい値を取ります。


しかし、系が外界に対して仕事をするときに正の値をとるので、それぞれの過程では符号のみが異なります。
つまり各過程における最大仕事を \(W_\text{max}^{\text{A} \rightarrow \text{B}}\)、\(W_\text{max}^{\text{B} \rightarrow \text{A}}\) とすると次式の成立が言えます。
\[ W_\text{max}^{\text{A} \rightarrow \text{B}} + W_\text{max}^{\text{B} \rightarrow \text{A}} = 0 \]
重要なことは可逆過程では外部に影響を残さずに系を元に戻すことができる点です。
式(1)で明らかなように、状態Aから変化して再度状態Aに戻したときに外界との仕事のやり取りがちょうど 0 になっています。
このように可逆過程とは系が元の状態に戻るだけではなく系の外部も元の状態に戻るのです。
不可逆過程
可逆過程とは異なり、系を元の状態に戻せない過程を不可逆過程と言います。
系が不可逆な過程をたどるのは、操作の途中で複雑な非平衡状態となるためです。
系を元通りに戻すとなれば、その複雑な過程をそのまま逆再生させる操作を行う必要がありそれは事実上不可能なのです。
※ただし後で分かるように、操作の最中に系の平衡状態が保持される場合であっても不可逆過程となる操作も存在します。
不可逆過程について更に理解するために次の操作を考えましょう。
\[ (T_\text{A}; ~ V_\text{A}, ~ n) ~ \xrightarrow{\text{a}} ~ (T_\text{B}; ~ V_\text{B}, ~ n) ~ \xrightarrow{\text{a}} ~ (T_\text{C}; ~ V_\text{A}, ~ n) \]
一連の操作では、初め系の体積が \(V_\text{A}\) の状態から \(V_\text{B}\) に変化させ、再度 \(V_\text{A}\) に戻しています。
また系の状態変化は操作前後の平衡状態のみに着目すれば良いので、操作(2)は中間状態を省略して次のように書くこともできます。
\[ (\textcolor{red}{T_\text{A}}; ~ V_\text{A}, ~ n) ~ \xrightarrow{\text{a}} ~ (\textcolor{red}{T_\text{C}}; ~ V_\text{A}, ~ n) \]
断熱系を操作した後、初期と同じ体積に戻したとしても不可逆過程をたどっているため系の状態は元には戻りません。そして操作(3)に示すとおり、操作前後の違いは温度変化として現れます。
重要なのはこれら温度の大小関係で、経験的事実に基づけば \(T_\text{A} < T_\text{C}\) と結論付けられます。つまり温度は上昇するということです。
身近な例を挙げるなら、手を擦り合わせたときに温度が上がっていく現象がまさしくコレですね。
この事実は熱力学において非常に重要で本質的な内容なので、次のようにまとめておきましょう。
系の体積を変えない不可逆的な断熱操作によって、系の温度を上げることができる
これが熱力学系を元の状態に戻せないという「不可逆性」を詳細にしたものになります。
※仮にこの事実に反する現象が見出されたとしても熱力学の範囲では扱いません。具体的に言うと、体積を変えない操作によって系の温度が下がったりなどですが、そういったことは想定していないわけです。先の例で考えても、実際に手を擦り合わせて温度が下がったという経験は無いはずです。
等温条件における不可逆過程は考えない
冒頭で可逆過程と不可逆過程は断熱系において用いられるべき概念であると述べました。
その理由を等温環境下に置かれた系を例に考えてみましょう。
系が平衡に達するよりも速く体積を \(V_\text{A}\) から \(V_\text{B}\) に変化させ、再度体積をもとに戻す操作を考えます。
\[ (T; ~ V_\text{A}, ~ n) ~ \xrightarrow{\text{i}} ~ (T; ~ V_\text{B}, ~ n) ~ \xrightarrow{\text{i}} ~ (T; ~ V_\text{A}, ~ n) \]
等温環境下に置かれた系では、断熱系とは異なり操作前後の温度が環境の温度 \(T\) と等しくなるため、明らかに不可逆であろう過程を経由させたとしても系の状態を元に戻すことができるのです。
このように等温条件において可逆か不可逆かを考えることに意味はありません。
ただし系の平衡を保持しながら操作するのか、あるいは素早く操作するのかという観点では各々の場合で挙動が異なる事は注意しなければなりません。
実際に等温準静的過程を考えることには熱力学的に重大な意味を持つことをこちらのページで解説しています。
可逆過程と準静的過程
前述の通り、系に可逆過程を経由させるためには準静的に操作する必要があります。
つまり可逆過程とは非常に長い時間を掛けて目的の状態にまで変化させることだと分かります。
では可逆過程と準静的過程の違いとは一体何でしょうか…。
それぞれの概念の意味を確認しておくと、
- 可逆過程 : 断熱系において2つの状態間を外部に影響を残さずにたどれる過程
- 準静的過程 : 系の平衡を保持しながら操作するときにたどる過程
という様に、それぞれは全く別のものです。
しかしながら作業ベースで見たとき、これらは同じ様に見えます…。
この疑問を一気に解決する図を示してしまいましょう!
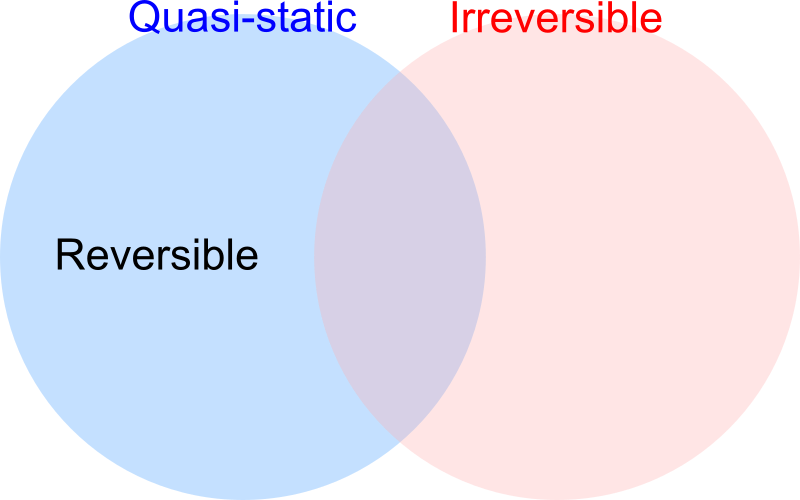
可逆過程は準静的過程に内包されており、可逆過程なら必ず準静的過程であると言えます。
だからこそ繰り返しになりますが、可逆過程であるなら準静的過程である必要があるということです。
逆に準静的過程なら可逆過程であると言うことはできません。
図中に不可逆過程との関係も示しましたが、図の通り系を準静的に操作しても不可逆過程となる場合があるのです。
例えば断熱系内を撹拌翼でかき混ぜるといった場合がこれに当たります。
詳しくは「ジュールの実験」についての解説ページをご覧ください。
以上のように可逆過程と準静的過程は作業ベースでは同じ様に見えるものの、概念としての違いがあることは理解しておくのが良いでしょう。
不可逆過程の例 : 断熱自由膨張
最後に不可逆的な現象の例を取り上げましょう。
次の図に示すような真ん中を仕切りで区切った断熱容器を用意し、片方には気体を、もう片方は真空にしておきます。
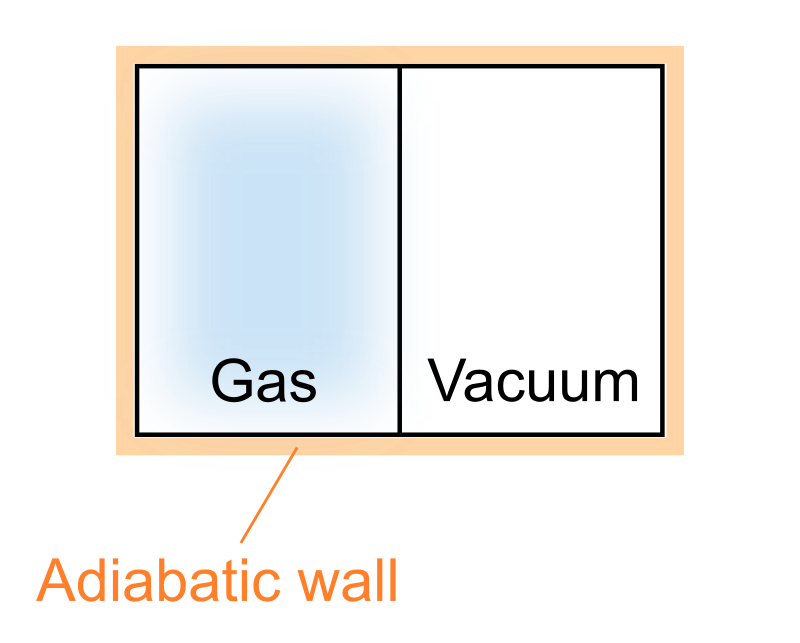
この状態から仕切りを取り外せば、気体は勢いよくもう片方の領域に流れ込みます。
仕切りを取り外すと言っても、ほんの小さな隙間を開けるだけでこの現象は起こります。
私達は仕切りを動かすという些細な「きっかけ」を与えただけですが、その後気体は自発的に膨張していきます。
またこのとき気体は外界に対して仕事をせずに膨張するという特徴があります。
「外界に仕事をする」というのは、簡単に言うと外界を押しのけて体積を大きくしようとすることを言います。
しかし、真空領域に気体が流れ込むとき系の外 ( 容器よりも外 ) には何も影響を及ぼしていません。
そのような理由からこの現象は断熱自由膨張と呼ばれます。
断熱自由膨張は不可逆な過程であるため元の状態に戻すことはできません。
その理由を考えてみましょう。
先程、容器の仕切りを取り外した事によって気体は自由膨張を開始しましたが、
もしこれが可逆過程であるなら仕切りを挿入する事で気体を容器の片隅に集められる過程が存在することになります。
しかしこれは経験的にも不可能であることはすぐに分かりますよね。
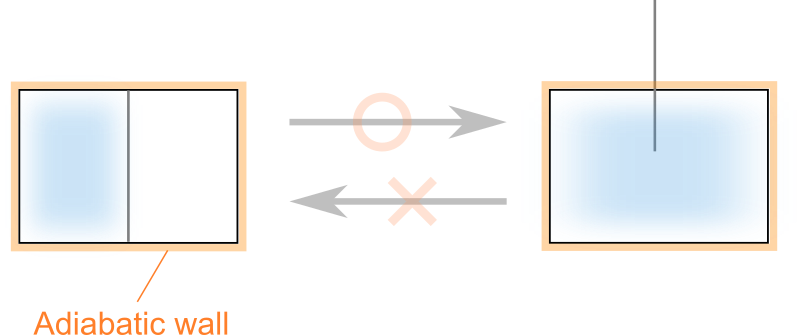
気体が容器全体に広がってしまった後、仕切りを挿入しても気体を等分することしかできません。
したがって気体の自由膨張は不可逆な過程であると言えそうです。
その他の方法で元に戻す方法はないでしょうか。
例えば、膨張した気体をピストンで圧縮することで元の状態に戻すという方法が考えられるかもしれません。
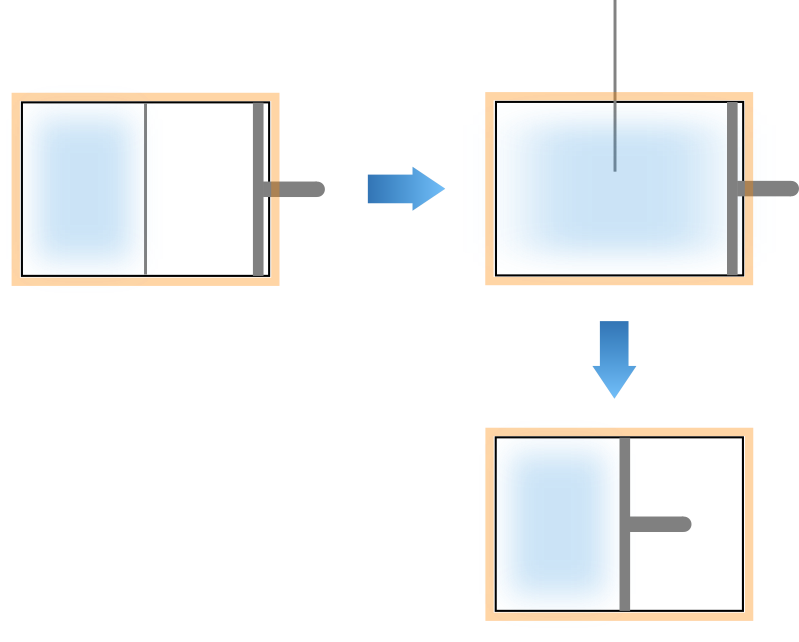
しかし残念ながらコレでも元の状態に戻すことはできません。
そもそも行きと帰りで操作方法が異なる点はさておき、気体を圧縮する過程で系に対して外から仕事をしている事が問題です。
前述の通り自由膨張では外界に対して仕事をしないので、逆操作では仕事しないで元の状態に戻さなければならず事実それは不可能です。
以上のように断熱自由膨張が不可逆性であることを何とか説明しようと努力しましたが…
実際は定量的に示したほうが信憑性がありますよね。
これは熱力学において重要な概念である「エントロピー」を利用して計算することができます。
エントロピーの定義や導入のメリットなど詳細に関しては以下のリンクを参照下さい。
まとめ
断熱系を初期状態から操作して、再度元の状態に戻せる過程を可逆過程と言います。
系を可逆的に変化させる最中では平衡を保持するために準静的に操作する必要があります。
しかし可逆過程と準静的過程は似て非なるものです。可逆過程は逆操作が可能な過程であり、準静的過程は系の平衡を保持するように操作するときの過程というそれぞれ異なる概念です。
一方で可逆過程のように系の状態を元に戻せないような過程を不可逆過程と言います。
断熱系を不可逆的に操作して、初めと同じ体積に戻しても系の温度は元より上昇してしまうのです。
このように不可逆的に温度上昇することは熱力学において本質的な内容であり、またこれを観測できるのは断熱系であるという事もまた重要です。
実際、等温条件下において可逆性や不可逆性を考えることに意味はありません。
それは系の温度は外部環境によって制御できるため、どのような操作をしたとしても系の状態をもとに戻すことができるためです。
【サイト運営 : だいご】
今年で物理化学歴13年目になります。
大学入試2次数学でたった3割しか得点できなかったいわゆる数弱落ちこぼれ。それでも好きこそものの上手なれと言ったところか、学会で最優秀賞受賞したり首席卒業できてしまったので、役に立つ知識を当サイトに全て惜しみなく公開しようと思います。ブックマークをオススメ。

